Volymfraktion. Lektionssammanfattning "Volymfraktion av gas i en blandning" Volymfraktion av gaser i en blandningsformel
Artikeln diskuterar ett sådant begrepp som massfraktion. Metoder för att beräkna den ges. Definitioner av kvantiteter som är likartade i ljud men olika i fysisk betydelse beskrivs också. Dessa är massfraktionerna för grundämnet och utbytet.
Livets vagga - lösning
Vatten är källan till liv på vår vackra blå planet. Detta uttryck kan hittas ganska ofta. Men få människor, förutom specialister, tänker: i själva verket var substratet för utvecklingen av de första biologiska systemen en lösning av ämnen, och inte kemiskt rent vatten. Säkert har läsaren stött på uttrycket "primärbuljong" i populärlitteratur eller TV-program.
De källor som gav upphov till livets utveckling i form av komplexa organiska molekyler är fortfarande omdiskuterade. Vissa föreslår till och med inte bara ett naturligt och mycket lyckligt sammanträffande, utan ett kosmiskt ingripande. Dessutom pratar vi inte om mytiska utomjordingar alls, utan om de specifika förutsättningarna för skapandet av dessa molekyler, som bara kan existera på ytan av små kosmiska kroppar utan en atmosfär - kometer och asteroider. Således skulle det vara mer korrekt att säga att en lösning av organiska molekyler är vaggan för allt levande.
Vatten som ett kemiskt rent ämne
Trots de enorma salta haven och hav, färska sjöar och floder, finns vatten ytterst sällan i sin kemiskt rena form, främst i speciella laboratorier. Låt oss komma ihåg att i den inhemska vetenskapliga traditionen är ett kemiskt rent ämne ett ämne som inte innehåller mer än tio till minus sjätte potensen av massfraktionen av föroreningar.

Att få en massa helt fri från främmande komponenter kräver otroliga kostnader och motiverar sällan sig själv. Det används endast i vissa industrier, där även en främmande atom kan förstöra experimentet. Observera att halvledarelement, som utgör grunden för dagens miniatyrteknologi (inklusive smartphones och surfplattor), är mycket känsliga för föroreningar. I deras skapelse behövs helt oförorenade lösningsmedel. Men jämfört med hela vätskan på planeten är detta försumbart. Hur kommer det sig att det utbredda vattnet som genomsyrar vår planet så sällan finns i sin rena form? Vi kommer att förklara lite nedan.
Idealiskt lösningsmedel
Svaret på frågan som ställdes i föregående avsnitt är otroligt enkelt. Vatten har polära molekyler. Det betyder att i varje minsta partikel av denna vätska är de positiva och negativa polerna inte mycket isär, utan separerade. I det här fallet skapar strukturer som uppstår även i flytande vatten ytterligare (så kallade väte) bindningar. Och totalt ger detta följande resultat. Ett ämne som kommer in i vatten (oavsett vilken laddning det har) dras isär av vätskans molekyler. Varje partikel av löst förorening omsluts av antingen negativa eller positiva sidor av vattenmolekyler. Således är denna unika vätska kapabel att lösa upp ett mycket stort antal av en mängd olika ämnen.

Begreppet massfraktion i lösning
Den resulterande lösningen innehåller en del av föroreningen, som kallas "massfraktionen". Även om detta uttryck inte förekommer ofta. En annan term som ofta används är "koncentration". Massfraktionen bestäms av ett specifikt förhållande. Vi kommer inte att ge ett formellt uttryck, det är ganska enkelt, låt oss bättre förklara den fysiska innebörden. Detta är förhållandet mellan två massor - förorening till lösning. Massfraktion är en dimensionslös mängd. Uttryckt olika beroende på specifika uppgifter. Det vill säga i bråkdelar av en enhet, om formeln bara innehåller ett massförhållande, och i procent - om resultatet multipliceras med 100%.
Löslighet
Förutom H 2 O används även andra lösningsmedel. Dessutom finns det ämnen som i grunden inte ger upp sina molekyler till vatten. Men de löser sig lätt i bensin eller varm svavelsyra.

Det finns speciella tabeller som visar hur mycket av ett visst material som kommer att finnas kvar i vätskan. Denna indikator kallas löslighet, och den beror på temperaturen. Ju högre den är, desto mer aktivt rör sig lösningsmedlets atomer eller molekyler, och desto fler föroreningar kan det absorbera.
Alternativ för att bestämma andelen löst ämne i en lösning
Eftersom arbetsuppgifterna för kemister och teknologer, såväl som ingenjörer och fysiker, kan vara olika, bestäms andelen av det lösta ämnet i vatten annorlunda. Volymfraktionen beräknas som volymen av föroreningen till den totala volymen av lösningen. En annan parameter används, men principen förblir densamma.
Volymfraktionen förblir dimensionslös, uttryckt antingen som bråkdelar av en enhet eller i procent. Molaritet (även kallad "molar volymkoncentration") är antalet mol av ett löst ämne i en given volym lösning. Denna definition innefattar redan två olika parametrar för ett system, och storleken på denna kvantitet är olika. Det uttrycks i mol per liter. För säkerhets skull, låt oss komma ihåg att en mol är mängden av ett ämne som innehåller ungefär tio till tjugotredje potens av molekyler eller atomer.
Begreppet massfraktion av ett element
Detta värde är endast indirekt relaterat till lösningar. Massfraktionen av ett grundämne skiljer sig från konceptet som diskuterats ovan. Varje komplex kemisk förening består av två eller flera grundämnen. Var och en har sin egen relativa massa. Detta värde kan hittas i Mendeleevs kemiska system. Där anges det i icke-heltal, men för ungefärliga problem kan värdet avrundas. Sammansättningen av ett komplext ämne inkluderar ett visst antal atomer av varje typ. Till exempel, i vatten (H 2 O) finns det två väteatomer och ett syre. Förhållandet mellan den relativa massan av hela ämnet och ett givet grundämne i procent kommer att vara grundämnets massandel.

För den oerfarna läsaren kan dessa två begrepp tyckas vara nära varandra. Och ganska ofta är de förvirrade med varandra. Massfraktionen av utbyte hänvisar inte till lösningar, utan till reaktioner. Alla kemiska processer inträffar alltid vid tillverkning av specifika produkter. Deras utbyte beräknas med hjälp av formler beroende på reaktanterna och processbetingelserna. Till skillnad från helt enkelt massfraktionen är detta värde inte så lätt att bestämma. Teoretiska beräkningar antyder maximalt möjliga mängd ämne i reaktionsprodukten. Övning ger dock alltid ett något mindre värde. Orsakerna till denna diskrepans ligger i fördelningen av energier bland även starkt upphettade molekyler.

Således kommer det alltid att finnas de "kallaste" partiklarna som inte kommer att kunna reagera och kommer att förbli i sitt ursprungliga tillstånd. Den fysiska betydelsen av massfraktionen av utbytet är hur stor procentandel av det faktiskt erhållna ämnet som är från det teoretiskt beräknade. Formeln är otroligt enkel. Massan av den praktiskt erhållna produkten divideras med massan av den praktiskt beräknade, och hela uttrycket multipliceras med hundra procent. Massfraktionen av utbytet bestäms av antalet mol av reaktanten. Glöm inte detta. Faktum är att en mol av ett ämne är ett visst antal av dess atomer eller molekyler. Enligt lagen om bevarande av materia kan tjugo molekyler vatten inte producera trettio molekyler svavelsyra, så problemen beräknas på detta sätt. Från antalet mol av den initiala komponenten härleds den massa som är teoretiskt möjlig för resultatet. Sedan, när man vet hur mycket av reaktionsprodukten som faktiskt producerades, bestäms massfraktionen av utbytet med hjälp av formeln som beskrivs ovan.
Koncentration- ett värde som kännetecknar lösningens kvantitativa sammansättning.
Koncentrationen av ett löst ämne (inte en lösning) är förhållandet mellan mängden av ett löst ämne eller dess massa och volymen av en lösning (mol/l, g/l), det vill säga det är ett förhållande mellan heterogena kvantiteter .
De kvantiteter som är förhållandet mellan liknande kvantiteter (förhållandet mellan massan av ett löst ämne och massan av en lösning, förhållandet mellan volymen av ett löst ämne och volymen av en lösning) kallas korrekt. aktier. dock på praktiken för båda typerna av uttryck av sammansättning används termen koncentration och prata om koncentrationen av lösningar.
Det finns många sätt att uttrycka koncentrationen av lösningar.
Massfraktion (även kallad procentkoncentration)
Massfraktion är förhållandet mellan massan av det lösta ämnet och lösningens massa. Massfraktion mäts i bråkdelar av en enhet.
m 1 - massa av löst ämne, g (kg);
m är lösningens totala massa, g (kg).
Massfraktion av löst ämne w (B) uttrycks vanligtvis som en bråkdel av en enhet eller som en procentandel. Till exempel är massfraktionen av den lösta substansen - CaCl 2 i vatten 0,06 eller 6%. Det betyder att en lösning av kalciumklorid som väger 100 g innehåller kalciumklorid som väger 6 g och vatten som väger 94 g.
Exempel: Hur många gram natriumsulfat och vatten behövs för att bereda 300 g av en 5% lösning?
Lösning: m (Na2SO4) = w (Na2SO4) / 100 = (5 300) / 100 = 15 (g)
där w (Na 2 SO 4)) är massfraktionen i %, m är lösningens massa i g m (H 2 O) = 300 g - 15 g = 285 g.
För att förbereda 300 g av en 5% natriumsulfatlösning måste du alltså ta 15 g Na 2 SO 4) och 285 g vatten.
Massprocent av komponent, ω%
ω % =(mi/Σm i)*100
Volymfraktion
Volymfraktion är förhållandet mellan volymen av ett löst ämne och volymen av en lösning. Volymfraktionen mäts i bråkdelar av en enhet eller i procent.
V 1 - volym löst ämne, l;
V - total volym lösning, l.
Det finns hydrometrar, utformad för att bestämma koncentrationen av lösningar av vissa ämnen. Sådana hydrometrar är kalibrerade inte i densitetsvärden, men direkt i lösningens koncentrationsvärden. För gemensamma lösningar etanol, vars koncentration vanligtvis uttrycks i volymprocent, sådana hydrometrar kallas alkoholmätare.
Molaritet (molar volymkoncentration)
Molär koncentration är mängden löst ämne (antal mol) per volymenhet lösning. Molar koncentration mäts i mol/l (M) eller mmol/l (mM). Uttrycket i "molaritet" är också vanligt. En lösning med en koncentration av 0,5 mol/l kallas alltså 0,5 molar.
ν - mängd löst ämne, mol;
V - total volym lösning, l.
Molar koncentration mäts i mol/L och betecknas "M". Till exempel är 2 M NaOH en tvåmolar lösning av natriumhydroxid. En liter av en sådan lösning innehåller 2 mol av ämnet eller 80 g.
Exempel: Vad är massan av kaliumkromat K 2 CrO 4 Behöver du ta 1,2 liter 0,1 M lösning för att förbereda?
Lösning: M(K 2 CrO 4) = C(K 2 CrO 4) V M(K 2 CrO 4) = 0,1 mol/l 1,2 l 194 g/mol » 23,3 g.
För att förbereda 1,2 liter 0,1 M lösning måste du alltså ta 23,3 g K 2 CrO 4 och lösa den i vatten och bringa volymen till 1,2 liter.
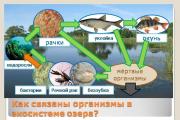
Luft innehåller flera olika gaser: syre, kväve, koldioxid, ädelgaser, vattenånga och några andra ämnen. Innehållet av var och en av dessa gaser i ren luft är strikt definierad.
För att uttrycka sammansättningen av en blandning av gaser i antal, d.v.s. kvantitativt används ett speciellt värde, som kallas volymfraktionen av gaser i blandningen.
Volymfraktionen av gas i en blandning betecknas med den grekiska bokstaven "phi".
Volymfraktionen av en gas i en blandning är förhållandet mellan volymen av en given gas och den totala volymen av blandningen:
Vad visar volymfraktionen av gas i blandningen eller, som de säger, vad är den fysiska betydelsen av denna mängd? Volymfraktionen av en gas visar hur mycket av den totala volymen av blandningen en given gas upptar.
Om vi kunde separera 100 liter luft i enskilda gasformiga komponenter skulle vi få cirka 78 liter kväve, 21 liter syre, 30 ml koldioxid, den återstående volymen skulle innehålla de så kallade ädelgaserna (främst argon) och några andra (fig. 62).
| Ris. 62. Atmosfärisk lufts sammansättning |
Låt oss beräkna volymfraktionerna av dessa gaser i luften:
Det är lätt att märka att summan av volymfraktionerna av alla gaser i en blandning alltid är lika med 1, eller 100%:
(kväve) + (syra) + (kolgas) + (andra gaser) = 78% + 21% + 0,03% + 0,97% = 100%.
Luften vi andas ut är mycket fattigare på syre (volymandelen minskar till 16%), men koldioxidhalten ökar till 4%. Denna luft är inte längre lämplig för andning. Det är därför som ett rum med många människor måste ventileras regelbundet.
Inom industriell kemi stöter man ofta på det motsatta problemet: att bestämma volymen gas i en blandning från en känd volymfraktion.
Exempel. Beräkna volymen syre som finns i 500 liter luft.
Från bestämningen av volymfraktionen av gas i blandningen uttrycker vi volymen syre:
V(sur) = V(luft) (sur).
Låt oss ersätta siffror i ekvationen och beräkna volymen syre:
V(sur) = 500 (l) 0,21 = 105 l.
Förresten, för ungefärliga beräkningar kan volymfraktionen av syre i luften tas lika med 0,2 eller 20%.
När du beräknar volymfraktionerna av gaser i en blandning kan du använda ett litet knep. Genom att veta att summan av volymfraktionerna är 100%, för den "sista" gasen i blandningen kan detta värde beräknas annorlunda.
Uppgift.En analys av Venus atmosfär visade att 50 ml venusisk "luft" innehåller 48,5 ml koldioxid och 1,5 ml kväve. Beräkna volymfraktionerna av gaser i planetens atmosfär.
Given:
V(blandningar) = 50 ml,
V(gas kol) = 48,5 ml,
V(kväve) = 1,5 ml.
Hitta:
(gasvinkel),
Lösning
Låt oss beräkna volymandelen koldioxid i blandningen. A-priory:
Låt oss beräkna volymfraktionen av kväve i blandningen, med vetskap om att summan av volymfraktionerna av gaser i blandningen är 100%:
(kolgas) + (kväve) = 100 %,
(kväve) = 100 % – (kolgas) = 100 % – 97 % = 3 %.
Svar.(kolgas) = 97 %, (kväve) = 3 %.
Vilken kvantitet används för att mäta innehållet av komponenter i blandningar av andra typer, till exempel i lösningar? Det är klart att det i detta fall är obekvämt att använda volymfraktionen. En ny mängd kommer till undsättning, som du kommer att lära dig om i nästa lektion.
1. Hur stor är volymandelen av en komponent i en gasblandning?
2. Volymfraktionen av argon i luft är 0,9 %. Vilken volym luft behövs för att producera 5 liter argon?
3. Genom att separera luften erhölls 224 liter kväve. Vilka volymer syre och koldioxid erhölls i detta fall?
4. Volymandelen metan i naturgas är 92 %. Vilken volym av denna gasblandning kommer att innehålla 4,6 ml metan?
5. Blandade 6 liter syre och 2 liter koldioxid. Hitta volymfraktionen av varje gas i den resulterande blandningen.
Volymfraktion är förhållandet mellan volymen av ett löst ämne och volymen av en lösning. Volymfraktionen mäts i bråkdelar av en enhet eller i procent.
där: V 1 - volym löst ämne, l;
V -- total volym lösning, l.
Som nämnts ovan finns det hydrometrar utformade för att bestämma koncentrationen av lösningar av vissa ämnen. Sådana hydrometrar kalibreras inte i densitetsvärden, utan direkt i lösningens koncentration. För vanliga lösningar av etylalkohol, vars koncentration vanligtvis uttrycks som en volymprocent, kallas sådana hydrometrar alkoholmätare eller andrometrar.
Molaritet (molar volymkoncentration)
molaritetskoncentrationslösning
Molär koncentration är mängden löst ämne uttryckt i mol som finns i en liter lösning. Molär koncentration i SI-systemet mäts i mol/m, men i praktiken uttrycks den mycket oftare i mol/l eller mmol/l.
En annan beteckning för den molära koncentrationen C M är möjlig, som vanligtvis betecknas M. En lösning med en koncentration av 0,5 mol/l kallas alltså 0,5 molar.
där: n - mängd löst ämne, mol;
V -- total volym lösning, l.
Mängden av ett ämne i mol är mängden ämne som motsvarar antalet mol vätejoner eller antalet mol elektroner i motsvarande reaktioner.
Molaritet beräknas på två sätt:
Metod 1- enligt den exakta massan av ett kemiskt rent ämne med hjälp av formeln:
M=a*1000/E*V,
där: a är massan av ett prov av ett kemiskt rent ämne, g;
E är molmassan av ekvivalenten (konventionella partiklar) av ett kemiskt rent ämne, g/mol;
V är volymen lösning som används för titrering av ämnets massa, ml;
1000 är antalet milliliter i 1 liter lösning.
Metod 2- från en titrerad lösning med känd koncentration med formeln:
M=M0 *V0/V,
där: M 0 - molariteten för lösningen av ämnet med vilken titern bestäms (mol/l); V 0 - volym lösning med vilken titern fastställs (ml); V är volymen av lösningen vars molaritet är inställd (ml).
Normal koncentration (molär koncentration ekvivalent)
Normal koncentration är antalet ekvivalenter av ett givet ämne i 1 liter lösning. Normal koncentration uttrycks i mol-eq/l eller g-eq/l (vilket betyder molekvivalenter). För att registrera koncentrationen av sådana lösningar används förkortningarna "n" eller "N". Till exempel kallas en lösning som innehåller 0,1 molekvivalenter/L decinormal och skrivs som 0,1 N.
där: n - mängd löst ämne, mol; V -- total volym lösning, 1; z -- ekvivalensnummer.
Den normala koncentrationen kan variera beroende på vilken reaktion ämnet är involverat i. Till exempel kommer en enmolar lösning av H 2 SO 4 att vara en-normal om den är avsedd att reagera med en alkali för att bilda vätesulfat KHSO 4, och två-normal om den är avsedd att reagera med bildning av K 2 SO 4.
Den molära volymen av en gas är lika med förhållandet mellan volymen av gasen och mängden ämne av denna gas, dvs.
Vm = V(X)/n(X),
där Vm är den molära gasvolymen - ett konstant värde för vilken gas som helst under givna förhållanden;
V(X) – volym av gas X;
n(X) – mängd gasämne X.
Den molära volymen av gaser under normala förhållanden (normaltryck p n = 101 325 Pa ≈ 101,3 kPa och temperatur T n = 273,15 K ≈ 273 K) är V m = 22,4 l/mol.
Idealiska gaslagar
I beräkningar som involverar gaser är det ofta nödvändigt att byta från dessa förhållanden till normala eller vice versa. I det här fallet är det bekvämt att använda formeln som följer från Boyle-Mariottes och Gay-Lussacs kombinerade gaslag:
pV/T = pn Vn/Tn
där p är tryck; V - volym; T - temperatur på Kelvin-skalan; indexet "n" indikerar normala förhållanden.
Volymfraktion
Sammansättningen av gasblandningar uttrycks ofta med hjälp av volymfraktionen - förhållandet mellan volymen av en given komponent och systemets totala volym, d.v.s.
φ(X) = V(X)/V
där φ(X) är volymfraktionen av komponent X;
V(X) - volym av komponent X;
V är volymen av systemet.
Volymfraktion är en dimensionslös kvantitet den uttrycks i bråkdelar av en enhet eller i procent.
Exempel 1. Vilken volym kommer ammoniak som väger 51 g att uppta vid en temperatur på 20°C och ett tryck på 250 kPa?
|
|
1. Bestäm mängden ammoniakämne: n(NH3) = m(NH3)/M(NH3) = 51/17 = 3 mol. 2. Volymen ammoniak under normala förhållanden är: V(NH3) = Vmn(NH3) = 22,43 = 67,2 1. 3. Med formeln (3) reducerar vi volymen ammoniak till dessa förhållanden (temperatur T = (273 + 20) K = 293 K): V(NH3) = pn Vn (NH3)/pTn = 101,3 293 67,2 / 250 273 = 29,2 1. Svar: V(NH 3) = 29,2 l. |
Exempel 2. Bestäm volymen som en gasblandning som innehåller väte, som väger 1,4 g, och kväve, som väger 5,6 g, kommer att uppta under normala förhållanden.
|
|
1. Hitta mängderna väte och kväveämnen: n(N2) = m(N2)/M(N2) = 5,6/28 = 0,2 mol n(H2) = m(H2)/M(H2) = 1,4/2 = 0,7 mol 2. Eftersom dessa gaser under normala förhållanden inte interagerar med varandra kommer volymen av gasblandningen att vara lika med summan av gasernas volymer, d.v.s. V(blandningar) = V(N2) + V(H2) = Vm n(N2) + Vm n(H2) = 22,4 0,2 + 22,4 0,7 = 20,16 l. Svar: V(blandning) = 20,16 l. |
Lagen om volymförhållanden
Hur löser man ett problem med "Law of Volumetric Relations"?
Lagen om volymförhållanden: Volymerna av gaser som är involverade i en reaktion är relaterade till varandra som små heltal lika med koefficienterna i reaktionsekvationen.
Koefficienterna i reaktionsekvationerna visar antalet volymer av reagerande och bildade gasformiga ämnen.
Exempel. Beräkna volymen luft som krävs för att bränna 112 liter acetylen.
1. Vi komponerar reaktionsekvationen:
2. Baserat på lagen om volymförhållanden, beräknar vi volymen syre:
112 / 2 = X / 5, där X = 112 5 / 2 = 280l
3. Bestäm volymen luft:
V(luft) = V(O 2) / φ(O 2)
V(luft) = 280 / 0,2 = 1400 l.