Особливості кругообігу води та деяких речовин у біосфері. Кисень у природі (49,4% у Земній корі) Круговорот кисню в природі схема та опис
Хімія, 8 клас Дата__________
Урок №___
Тема урока:Властивості та застосування кисню. Кругообіг кисню в природі
Мета уроку:вивчити фізичні та хімічнівластивості кисню, дати загальне поняття про оксиди,реакції горіння; розглянути
практичнузначимість та застосування;д надати, що кисень -один із найважливіших елементів на Землі.
З адачі уроку:
Освітні :
Розширити уявлення учнів про кисень.
Ознайомити з властивостями та застосуванням кисню.
Удосконалювати вміння складати рівняння хімічних реакцій.
Виховні :
Формувати вміння працювати в парах у кожного учня, зважати на думку сусіда і відстоювати свою точку зору коректно, виконуючивправи.
Виховувати дбайливе ставлення до свого здоров'я, навколишньої природи, вчити розуміти прекрасне, цінувати витвори мистецтва.
Розвиваючі :
Сприяти продовженню розвитку сталого інтересу до хімічної науки та практики.
Удосконалювати навички самостійної роботи, розвивати вміння спостерігати, формулювати висловлювання.
Сприяти розвитку дослідницьких навичок,дотримуючись правил техніки безпеки.
Удосконалювати вміння узагальнювати та робити висновки.
Заплановані результати:
особистісні: готовність та здатність учнів до саморозвитку, самовизначення; відповідальне ставлення до навчання; здатність ставити цілі та будувати життєві плани; формування комунікативної культури, цінності здорового та безпечного способу життя;
метапредметні: вміти ставити мету і планувати шляхи її досягнення, обираючи раціональніші способи вирішення даної проблеми; вчитися коригувати свої дії у зв'язку зі зміною ситуації, що склалася; вміти створювати, застосовувати та перетворювати знаки та символи, моделі та схеми для вирішення навчальних та пізнавальних завдань; вміти усвідомлено використовувати мовні засоби відповідно до завдання комунікації для вираження своїх думок та потреб; вміти організовувати спільну роботу з однолітками у парах; вміти знаходити інформацію у різних джерелах; володіти навичками самоконтролю, самооцінки;
предметні:
знати : основні хімічні поняття "каталізатори", "оксиди", "реакції горіння", "реакції окислення"; фізичні та хімічні властивості кисню; сфери застосування кисню.
вміти: відрізнити кисень з інших газів; становити рівняння реакцій горіння речовин у кисні; записувати хімічні формули оксидів та давати їм назви; пояснювати, як відбувається кругообіг кисню в природі.
Тип уроку: урок формування умінь та навичок.
Форма роботи: фронтальна, групова, робота у парах, ігрова.
Методи навчання: словесний, частково пошуковий, наочний, демонстраційний, інтерактивний.
Прийоми навчання : постановка проблемних питань
Обладнання:комп'ютер, проектор, презентація«Властивості та застосування кисню. Колообігкисню в природі», пробірка з
газовідвіднийтрубкою, колба, скляна пластина, пінцет, ложкадля спалювання речовин, штатив, спиртування,універсальна
індикаторний папір, хімічнийсклянка.
Реактивы:до фосфор, вода.
Література:
Для вчителя:
Горковенко М. Ю. Поурочні розробки з хімії 8 клас до підручників О. С. Габрієляна, Л. С. Гузея, Г. Є. Рудзітіса. - М: "ВАКО", 2004;
Радецький А. М., Горшкова В. П. Дидактичний матеріал: хімія 8-9 класи – М: Просвітництво, 1997.
Для учня:
Хімія: неорганічна хімія: підручник для 8 класу загальноосвітніх установ/Г. Є. Рудзітіс, Ф. Г. Фельдман. – М: «Освіта», 2014 р.
Інтернет ресурси:
http://www.e-osnova.ru/
ХІД УРОКУ
І. Організаційний момент.(1 хв.) (Слайд №1)
Вчитель: Добридень! Прошу всіх сідати. Я вітаю вас ще з одним чудовим днем. І ми з вами продовжуємо творити чаклунство на уроках хімії.
ІІ. Актуалізація знань.(7 хв.).
Фронтальне опитування «А ну, хіміки» . (Слайд №2)
Вчитель:Сьогодні на уроці ми вивчимо властивості тазастосування кисню. Кругообіг кисню вприроді. Але перед тим як
приступити до вивченнянової теми, вам слід відповісти на наступніпитання:2 учнів отримують завдання на картках та
Виконують його біля дошки:
На якій діаграмі розподіл масових часток елементів відповідає
кількісним складом(NH 4 ) 3 PO 4 ? Відповідь: 4.
Фронтальне опитування
Хімічний знак кисню? Відповідь: Про
Відносна атомна маса кисню? Відповідь: 16.
Хімічна формула кисню? Відповідь: О2.
Відносна молекулярна маса кисню? Відповідь:32.
У сполуках кисень зазвичай якоїсь валентності? Відповідь:ІІ.
Розкажіть про знаходження кисню у природі. Відповідь: Кисень - найпоширеніший хімічний елемент у земній корі. Кисень - найпоширеніший на Землі елемент, на його частку припадає близько 49% твердої земної кори. Морські та прісні води містять величезну кількість пов'язаного кисню - 85,5% (за масою), в атмосфері вміст вільного кисню становить 21% за обсягом та 23% за масою. Понад 1500 з'єднань земної кори у своєму складі містять кисень. Кисень входить до складу багатьох органічних речовин і є присутнім у всіх живих клітинах. За кількістю атомів у живих клітинах він становить 20,9%, за масовою часткою – близько 65%.
Чи перерахуєте способи отримання кисню в лабораторії? Відповідь:
Улабораторії кисень одержують наступними
способами:
1) Розкладання перманганату калію. 2KMnO4 = K2MnO4+MnO2+O2
2) Розкладання перекису водню. 2H2O2 = 2H2O + O2
3) Розкладання бертолетової солі. 2KClO3 = 2KCl + 3O2
8. Перерахуйте способи отримання кисню у промисловості. Відповідь: В промисловості кисень отримують:
1) Електроліз води. 2H2O = 2H2 + O2
2) З повітря. Повітря тиск, -183˚C=O2 (блакитна рідина).
Нині у промисловості кисень одержують із повітря. У лабораторіях невеликі кількості кисню можна одержувати нагріванням перманганату калію (марганцівка) KMnO4. Кисень мало розчинний у воді і важчий за повітря, тому його можна отримувати двома способами:
9. Встановіть відповідність між способом отримання кисню та рівнянням хімічної реакції. Робота у парах.(Слайд №3)
|
Способи одержання кисню |
Рівняння хімічних реакцій |
|
А. Розкладання перманганату калію. Б. Розкладання перекису водню. Ст. Розкладання бертолетової солі. р. Електроліз води. Д. З повітря. |
1) 2KClO 3 = 2KCl + 3O 2 2) 2H 2 O 2 = 2H 2 O + O 2 3) ПОВІТРЯ = O 2 4) 2KMn O 4 = K 2 Mn O 4 + Mn O 2 + O 2 5) 2H 2 O = 2H 2 + O 2 |
Відповідь: А-4; Б-2; В 1; Г-5; Д-3.
10. Що називають каталізаторами? Де ці речовини застосовуються?Відповідь: Речовини, які прискорюють хімічні реакції,
але самі при цьому не витрачаються, називають каталізаторами. Каталізатори широко застосовують у хімічній промисловості. З
їх допомогою вдається підвищити продуктивність хімічних процесів, знизити собівартість продукції і більше
повно використовувати сировину.
ІІІ. Вивчення нового матеріалу.(12 хв.) (Слайд №4)
Вчитель: Фізичні властивості. Кисень -безбарвний газ, без смаку та запаху, відносномалорозчинний у воді (у 100 обсягах
Води за температури 20ºЗ розчиняється 3,1 об'єму кисню). Кисень трохи важчийповітря: 1л кисню принормальних
умовах важить 1,43 г, а 1л повітря -1,29г. (Нормальні умови - скорочено: н.у. - температура 0ºС та тиск 760 мм.рт.ст., або
1 атм. ≈ 0,1 МПа). При тиску 760мм рт.ст. та температурі -183ºС кисень зріджується, а при зниженні температури до -218,8ºС
твердне.
(Слайд №5) Хімічні властивості. Кисень при нагріванні енергійно реагує з багатьма речовинами, при цьому виділяються
Теплота та світло. Такі реакції називають реакціями горіння. Якщоопустити в посудину з киснем O 2 тліючий вугілляк, то він
Розжарюється до білого і згоряє, утворюючи оксид вуглецю ( IV) З O 2 . Щоб визначити, яка утворилася речовина, в посудину наливають
Вапняну воду - розчин гідроксиду кальцію Са(ОН) 2 . Вона каламутніє, тому що при цьому утворюється нерозчинний карбонат.
Кальція СаС O 3 :
CO 2 + Ca(OH) 2 = CaCO 3 ↓ + H 2 O
(Слайд №6)Сірка горить у O 2 яскравим синім полум'ям з утворенням газу з різким запахом - оксиду сірки( IV)
S + O 2 = SO 2
(Слайд №7) Демонстраційний досвід «Горіння фосфору в кисні»
Техніка безпеки (провести інструктаж!) Досвід слід проводити під тягою. Слід дотримуватися правил поводження з
Нагрівальними приладами. Не допускати попадання фосфору на робочу поверхню столу. Не вдихати виділяється
Дим фосфорного ангідриду.
Фосфор Р згоряє в O 2 яскравим полум'ям з утворенням білого диму, що складається з твердих частинок оксиду фосфору( V).
4P + 5O 2 = 2P 2 O 5
(Слайд №8) У кисні горять і такі речовини, які зазвичай вважають негорючими, наприклад, залізо. Якщо до тонкої сталевої
Дроті прикріпити сірник, запалити його та опустити в посудину з киснем, то від сірника загориться і залізо. Горіння заліза
Відбувається з тріском і розкиданням яскравих розпечених іскор - розплавлених крапель залізної окалини. Fe3O4. В цьому
З'єднанні два атоми заліза тривалентні і один двовалентний. Тому реакцію горіння заліза у кисні можна виразити
Наступним рівнянням:
3 Fe + 2 O 2 = FeO * Fe 2 O 3 або Fe 3 O 4
(Слайд №9) Взаємодія речовини з киснем відноситься дореакцій окислення .
(Слайд №10) Горіння - це хімічна реакція, коли відбувається окислення речовин із теплоти і світла.
Найчастіше при взаємодії речовин із киснем утворюються оксиди.(Слайд №11) Оксиди – це складні
Речовини, які складаються із двох елементів, одним з яких є кисень.
(Слайд №12) Відомі хімічні елементи, які безпосередньо з киснем не з'єднуються. До них відносяться золото Au та
Деякі інші. Оксиди цих елементів одержують непрямим шляхом.
(Слайд №13) Застосування кисню. Засноване на його хімічних властивостях. У великих кількостях кисень використовують для
Прискорення хімічних реакцій у різних галузях хімічної промисловості та у металургії. Наприклад, при виплавці чавуну
Для підвищення продуктивності доменних печей у них подають повітря, збагачене киснем.
(Слайд №14) При спалюванні суміші ацетилену або водню з киснем у спеціальних пальниках температура полум'я досягає
3000 º Таке полум'я використовується для зварювання металів. Якщо беруть кисень у надлишку, то полум'ям можна різати метал.
(Слайд №15) Рідкий кисень застосовують у ракетних двигунах.
(Слайд №16) У медицині кисень служить полегшення утрудненого дихання. У цьому випадку киснем заповнюють
Спеціальні подушки. Кисневі маски необхідні у висотних польотах, у космосі та під час роботи під водою.
(Слайд №17) Кисень витрачається у величезних кількостях на багато хімічних реакцій, наприклад на спалювання палива.
(Слайд №18) Зі сказаного видно, що дуже багато кисню витрачається на різноманітну діяльність людини, витрачається на
Процеси дихання людини, тварин, рослин, і навіть процеси гниття. Людина при диханні протягом 1 хв у середньому
Вживає 0,5 дм³ кисню, протягом доби - 720 дм³, а на рік – 262,8 м³ кисню, що всі жителі земної кулі (5 мільярдів)
Протягом року для дихання використовують 1578 мільярдів кубічних метрів кисню. Якщо такий обсяг кисню за нормального
Тиск помістити в залізничні цистерни, то потяг був би протяжністю більше 300 млн км, що дорівнює відстані до
Сонце і назад.
(Слайд №19) Але все ж таки загальна маса кисню в повітрі помітно не змінюється. Це пояснюється процесом фотосинтезу,
Що відбувається в зелених рослинах на світлі. Внаслідок цього процесу виділяється кисень.
З фотосинтезом ви вже знайомилися у курсі ботаніки. Спрощено процес фотосинтезу зображують так:
6CO 2 + 6H 2 O = C 6 H 12 O 6 + 6O 2 .
Так у природі відбувається безперервний кругообіг кисню.
(Слайд №20) З метою збереження кисню у повітрі навколо міст та великих промислових центрів створюються зони зелених
Насаджень. Спеціальна служба систематично контролює вміст кисню у повітрі. При необхідності застосовують
Заходи щодо усунення забруднення повітря.
(Слайд №21) Фізкультхвилинка. (1 хв.)
Руки вгору піднімаємо,
А потім їх відпускаємо.
А потім їх розгорнемо
І до себе скоріше притиснемо.
А потім швидше, швидше
Плещи, плескай веселіше.
IV. Закріплення знань. (6 хв.)
(Слайд №22) Завдання №1. "Правда чи брехня? Якщо знаєш – розбереш»
Для кисню вірні такі твердження:
а) Кисень – безбарвний газ, без смаку та запаху.
б) Кисень трохи легший за повітря.
в) У кисні горять і такі речовини, які вважають негорючими, наприклад залізо.
г) Відомі хімічні елементи, які безпосередньо з киснем з'єднуються. До них відносяться золото Au та деякі інші.
д) Застосування кисню ґрунтується на його фізичних властивостях.
е) Безперервний кругообіг кисню безпосередньо пов'язаний з таким процесом, як фотосинтез.
Відповідь:а; в; е.
(Слайд №23) Завдання №2. "Швидка допомога"
Вставте пропущені речовини у рівняннях реакцій:
а) …….. + Ca(OH) 2 = CaCO 3 ↓ + H 2 O
б) S + …….
= SO 2
Відповідь:в) ….. + 2 O 2 = FeO * Fe 2 O 3 або Fe 3 O 4
а)CO 2 б)O 2 в) 3 Fe(Слайд №24)
Завдання №3. "Мозковий штурм"
Розставте коефіцієнти рівняннях реакцій.
а) CO 2 + H 2 O = C 6 H 12 O 6 + O 2
б) P + O 2 = P 2 O 5(Слайд №25)
Завдання №4. "Асоціації"
З яким застосуванням кисню асоціюється це зображення?(Слайд №26)
1) у металургії;(Слайд №27)
2) в авіації для двигунів;(Слайд №28)
3) в авіації для дихання;(Слайд №29)
4) для різання металів;(Слайд №30)
5) для зварювання металів;(Слайд №31)
6) на вибухових роботах;(Слайд №32)
7) у медицині.(Слайд №33)(1 хв.)
V. Домашнє завдання.
§20,21; №6-9 (с.60). Розв'яжіть задачі 1-2 (с.60).Творче завдання:
підготувати повідомлення №10 с. 60 «Що робиться у вашій місцевості для підтримки певного змісту
7) у медицині.VI. Рефлексія.(1 хв.)
Вчитель:
З його я дізнався...
було важко…
Я зрозумів, що…
я навчився…
я зміг…
було цікаво дізнатися, що…
мене здивувало…
мені захотілось…
VII.Підбиття підсумків уроку.(1 хв.)
(Слайд №34)У чому горять дрова та газ,
Фосфор, водень, діамант?
Дихає чим будь-хто з нас
Кожну мить і кожну годину?
Без чого мертва природа?
Правильно, без.Учні:
кисню
Вчитель:Правильно. Дякую за урок! До побачення! (Слайд №35)
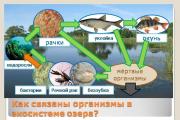
Кругообіг кисню планети Земля - одне із основних процесів, якому зобов'язані своїм існуванням всі форми життя. Які особливості та основні складові цього масштабного дійства? Саме це питання ми спробуємо знайти відповідь.
Характеристика кисню як елемента
Щоб зрозуміти суть глобального процесу, розглянемо його основну складову. Перше, потім звернемо увагу, - характеристика кисню як головного елемента круговороту. Він існує у кількох видах: власне оксигеніум (або оксиджен) – легкий неметал таблиці Менделєєва, який позначають латинською літерою O; невидимий безсмачний і безбарвний газ, утворений двома молекулами O 2 , що називається дикислород. Цей газ вважають найсильнішим та найпоширенішим окислювачем. Можна виділити і ще одну форму - озон, який є сполукою вже трьох молекул O. Кисень - друга головна складова атмосфери нашої планети, яка, як ми пам'ятаємо, майже на 80% складається з азоту. Дещо менше 20% припадає на частку кисню.
Головні «споживачі» оксигеніуму

Кругообіг кисню в біосфері Землі - складний і постійний процес, який підтримує та зберігає можливість життєдіяльності тварин, рослин та людини. У складній взаємодії відбувається постійне поновлення запасів цього безцінного газу. Людина та плоди її праці в цьому процесі є головними споживачами. Люди і тварини в природному процесі дихання поглинають кисень, видихаючи вуглекислий газ. Промислові та ресурсодобувні підприємства, автомобільний транспорт також виділяють в атмосферу величезну кількість шкідливих речовин та домішок, спалюючи тонни кисню та зменшуючи відсоток його у навколишньому середовищі.
Трохи про фотосинтез
Відновлення життєво важливого елемента відбувається завдяки такому процесу, як фотосинтез. Перетворення вуглекислого газу на кисень - заслуга флори нашої планети. Саме рослини мають цю дивовижну здатність - щодня заповнювати цей цінний газ, спожитий людиною та представниками тваринного світу. У чому суть фотосинтезу? Якщо говорити простою мовою, то він є нічим іншим, як поглинанням з навколишнього середовища вуглекислого газу з наступним виділенням

її кисню. Наземні рослини отримують його з атмосфери та землі через коріння та листя, а водорості використовують газ, розчинений у воді. Саме завдяки такій особливості життєдіяльності земної флори кількість кисню на планеті відновлюється в обсязі, необхідному для існування життя.
Схема круговороту
Якщо описувати кругообіг кисню схематично, то він виглядатиме таким чином: виділення елемента походить з рослин на воді та землі. Нещодавно вченими було доведено, що невелика частина цього газу з'являється і в атмосфері як наслідок розкладання водяної пари під впливом сонячних променів. Поглинають її люди, тварини, промислові підприємства. Кругообіг кисню можна порівняти з роботою легень людини. Саме він дозволяє нашій планеті дихати – на жаль, з кожним роком робити це Землі все складніше.
Кисень - найпоширеніший елемент земної кори. У вільному стані він знаходиться в атмосферному повітрі, у зв'язаному вигляді входить до складу води, мінералів, гірських порід та всіх речовин, з яких побудовані організми рослин та тварин.Масова частка кисню у земній корі становить близько 47%.
Кисень - безбарвний газ, що не має запаху. Він трохи важчий за повітря. Кисень відіграє винятково важливу роль у природі. За участю кисню відбувається один із найважливіших життєвих процесів - дихання. Важливе значення має й інший процес, у якому бере участь кисень - тління та гниття загиблих тварин та рослин; при цьому складні органічні речовини перетворюються на простіші (в кінцевому результаті в CO 2 , воду і азот), а останні знову вступають у загальний кругообіг речовин у природі.
Кисень - найактивніший газ. У межах біосфери відбувається швидкий обмін кисню середовища з живими організмами чи його залишками після загибелі.
У складі земної атмосфери кисень посідає друге місце після азоту. Пануючою формою знаходження кисню у атмосфері є молекула Про 2 . Кругообіг кисню в біосфері дуже складний, оскільки він входить у безліч хімічних сполук мінерального та органічного світів.
Головним чином кругообіг кисню відбувається між атмосферою та живими організмами. В основному вільний кисень (Про 2) надходить в атмосферу в результаті фотосинтезу зелених рослин, а споживається в процесі дихання тваринами, рослинами та мікроорганізмами, та при мінералізації органічних залишків (гниття різних речовин). Незначна кількість кисню утворюється з води та озону під впливом ультрафіолетової радіації.
В історії біосфери Землі настав такий час, коли кількість вільного кисню досягла певного рівня і виявилася збалансованою таким чином, що кількість кисню, що виділяється, стала рівною кількості поглинається кисню.
Велика кількість кисню витрачається на окислювальні процеси у земній корі, при виверженні вулканів тощо.
Основна частка кисню продукується рослинами суші – майже 3/4, решта – фотосинтезуючими організмами Світового океану. Швидкість круговороту – близько 2 тис. років.
Об'єми потоків кисню і кисневмісних сполук, що встановилися в біосфері, в сучасних умовах порушуються техногенними міграціями. Промислові, побутові та сільськогосподарські відходи, скинуті у природні води (річки, озера, моря, океани), пов'язують розчинений у воді кисень, що також порушує обсяги кисневих потоків у біосфері. Забруднення ґрунтів, зведення лісів зменшує обмін киснем та діоксидом вуглецю між атмосферою та сушею. Однак запаси кисню на планеті невичерпні. Він входить до складу кристалічних ґрат мінералів і вивільняється з них за допомогою живої речовини. Тому для підтримки об'ємів кисневих потоків, що встановилися, в біосфері необхідне збереження живої речовини як головної геохімічної сили.
Встановлено, що на промислові та побутові потреби щорічно витрачається 23% кисню, що утворюється у процесі фотосинтезу, і ця цифра постійно зростає.
Кисеньатмосфера накопичена в результаті діяльності зелених рослин. Потрібно було близько 2,5–3 млрд. років для створення сучасного складу атмосфери, що містить 21% кисню.
Весь вільний кисень в атмосфері оцінюється в 1,6×10 9 т. Ця кількість споживається на дихання живими організмами за 2 тис. років, що й становить час повного кругообігу кисню в біосфері.
Кругообіг кисню в біосфері (Клауд, Джибор, 1972)
У верхній межі тропосфери під впливом космічних випромінювань із кисню утворюється озон. Отже, озоновий екран, що оберігає життя від смертоносних випромінювань, також є результатом діяльності живої речовини, тобто життя само захищає себе від смерті. Цей факт підтверджує гіпотезу Ген, через яку глобальні процеси, що визначають межі життя, регулюються лише біологічними процесами самої біосфери.
Все у світі складається з хімічних елементів. Вони ж підтримують життя Землі. Одну з найважливіших ролей у цій справі грає кисень. З ним пов'язано безліч цікавих фактів, а кругообіг кисню в природі дивовижний. Бажаєте знати більше? Читайте далі.
Отже, що цікавого пов'язано з киснем:
1. Виробляють як рослини.
Багатьом зі шкільної лави відомо, що оксиген утворюється внаслідок фотосинтезу рослин. Так, саме перетворення вуглекислого газу рослинністю – основне джерело кисню на Землі. Однак він не єдиний.
Частина газу утворюється у верхніх шарах атмосфери під впливом сонячних променів. Нагріваючись, молекули води розпадаються на складові, утворюючи водень і кисень.
Крім того, близько половини всього вільного кисню на планеті виготовляє фітопланктон. Вуглекислий газ, який вони споживають, потрапляє в атмосферу внаслідок дихання тварин та людей, а також під час окиснення, тобто згоряння.
Просто кругообіг кисню в біосфері можна описати так:
- Під дією сонячного тепла вода зі світового океану випаровується. Її частина, потрапляючи у верхній шар атмосфери, розпадається на H2 та O2.
- Кисень у свою чергу переробляється живими істотами, які виділяють вуглекислий газ. Також чадний газ потрапляє в атмосферу внаслідок згоряння матерії.
- У процесі фотосинтезу вуглекислий газ перетворюється знову на кисень.
Примітка:також оксиген виділяється з вапняку шляхом вивітрювання породи.
2. Кисень використовували алхіміки.
Про цей елемент було відомо ще у VIII столітті. Перші згадки зустрічаються у рукописах китайського вченого-алхіміка Мао Хоа. Звичайно, тоді кисень мав зовсім іншу назву, та й про її властивості мало що було відомо.
Легендарний художник, інженер, біолог та хімік Леонардо да Вінчі вивчав кисень, але навіть не здогадувався, що кисень – це окремий елемент.
Проте офіційне відкриття кисню відбулося 1774 року. Статус першовідкривача дістався Джозефу Прістлі, якому вдалося виділити кисень із оксиду ртуті. Вчений довго не міг зрозуміти, чому під час нагрівання матеріалу свічка, яка служила джерелом світла, горіла набагато яскравіше. Згодом Прістлі назвав це явище «Друге повітря». Але, як часто буває у науковому світі, тут не обійшлося без скандалу.
Пізніше стало відомо, що шведський дослідник природи Карл Шееле зміг виділити кисень з оксиду азоту в 1771 році. Дані про експеримент він записав у свою книгу, яку, на жаль, видали лише через шість років.
3. Кисень потрібен скрізь.
Застосування кисню не обмежується простим подихом. Його широко використовують як окислювач у металургії. Без нього було б неможливе виробництво якісної сталі. Також газ використовується в ацетиленових та водневих пальниках для різання та зварювання металу.
Кисень забезпечує роботу теплових електростанцій. Двигуна внутрішнього згоряння ніколи не було б, оскільки наявність оксигену - головна умова детонації паливної суміші.
Космонавти, військові льотчики та аквалангісти використовують для дихання балони, наповнені киснем у зв'язці з гелієм або іншими інертними газами. Таким чином, кисень сприяє дослідженню океанів та космосу.
4. Кисень - джерело краси та здоров'я.
Кисень широко застосовується в медицині та при виготовленні косметичних засобів. З його допомогою рятують від задухи, гіпоксії, нападів астми та людей із хворобами серцево-судинної системи.
Безалкогольні коктейлі із високим вмістом оксигену корисні для вагітних жінок. Кисневий напій сприяє нормальному розвитку плода. Також подібні склади покращують психоемоційний стан людини і надають бадьорості.
Оксиген додають у косметичні креми та маски. Ці засоби покращують стан шкіри, омолоджують та надають еластичності.
5. Три трильйони тонн кисню на рік.
Приблизно стільки кисню виробляє вся зелена рослинність Землі. Найбільшими природними фабриками цього газу вважаються ліси Амазонки та сибірська тайга. Ці місця називають "легкими планети".
Примітка:одне велике дерево виробляє достатньо кисню, щоб забезпечити двох людей – приблизно 125 кг газу на рік.
6. Концентрація кисню знижується.
Незважаючи на значний обсяг вироблення, вміст кисню в атмосфері становить у кращому випадку 21%. У містах це значення опускається до 18%. До речі, лише кілька мільйонів років тому цей показник був удвічі вищим.
Причина зниження концентрації кисню у збільшенні кількості автомобільного транспорту, виробничих викидів та неконтрольованій вирубці лісів.
7. Що буде, якщо кисень зникне на секунду?
Якщо це станеться, світ, який ми знаємо, перестане існувати. Ні, рослини не зав'януть, а тварини не задихнуться. Все буде значно гіршим. Оксиген входить до складу практично всього та всіх.
Бетонні будівлі тут же обваляться, моря і океани випаруються, живі істоти висохнуть і перетворяться на пил. Як доповнення до апокаліптичної картини уявіть, що земна кора розверзлася, а небо стало чорним, як ніч.
Збільшення кількості кисню в 10 разів також не обіцяє нічого хорошого, хоча наслідки не будуть настільки драматичними. Цей сценарій загрожує масовим вимиранням через гіпервентиляцію легень. Однак швидше за все життя не зникне, а відродиться в іншій формі.
8. У землі кисню більше, ніж у повітрі.
Мало хто знає, але основний запас кисню зосереджений над атмосфері. Вільного кисню на планеті всього 0,36%, причому близько 99,5% газу входить до складу гірських порід, силікатів, мантії та земної кори.
9. Ера гігантів стала можливою завдяки кисню.
До початку панування динозаврів, 300 мільйонів років тому, концентрація кисню була в десятки разів більшою. Вчені вважають, що завдяки цьому на Землі довгий час правили гіганти.
У ті далекі часи на планеті можна було зустріти сороконіжку завдовжки 2,5 метри. Серед ящерів найбільшим був Дредноут. Його довжина сягала 26–30 м, а вага – 60 тонн.
Нещодавно завдяки оксигену по планеті ходив шестиметровий лінивець. А як щодо двометрового кабана, який харчувався переважно м'ясом? Деякі ссавці, наприклад індрикотерій, зростання яких досягало 8 м, а вага 15 тонн, не поступалися в розмірах динозаврам.
Первісні люди встигли полювати на мамонта, який майже вдвічі перевершував за розмірами сучасного слона. В останній льодовиковий період пліч-о-пліч з людиною розумною жили ведмеді під три метри в загривку і двометрові олені.
10. Ком в горлі і очі, що пересихають.
При сильному стресі у людини інстинктивно частішає подих. Нерідко збільшується і обсяг кисню, що вдихається, за раз. Через це голосова щілина розширюється, викликаючи відчуття кома у горлі.
Примітка: нерідко ком у горлі - це симптом серйозних захворювань, тому, якщо згодом подібне відчуття не минає, зверніться до лікаря.
Ті, хто піднімався високо в гори, стикався із синдромом сухого ока. Це неприємне відчуття пояснюється низьким вмістом кисню на великій висоті. Справа в тому, що рогівка не містить судин, а поживні речовини та оксиген доставляються до неї через слізні залози зовнішнім способом.
Кругообіг кисню - разючий процес. Уявити складно, як на нашій планеті все взаємопов'язане і наскільки тендітний цей зв'язок. Тому ми, як розумні істоти, маємо взяти на себе відповідальність за збереження балансу в природі.
>>
Кругообіг Оксигену у природі. Застосування кисню
У цьому параграфі йдеться:
Сукупність процесів, що відбуваються в природі, при яких атоми або іони елемента в результаті реакцій переходять від одних речовин до інших, називають кругообігом елемента.
Кругообіг Оксигену.
Якщо головним речовиною у кругообігу Оксигену вибрати кисень, можна виділити такі ланки круговороту (схема 8):
Витрати, або зв'язування, кисню(процеси дихання, згоряння палива та пального, окислення різних речовин у природі, у технологічних процесах);
Взаємоперетворення оксигенсодержащих сполук;
Схема 8. Кругообіг Оксигену (основні ланки)
Освіта кисню (процес фотосинтезу, розкладання води у верхніх шарах атмосфери).
Незмінність вмісту кисню в атмосфері свідчить про те, що зв'язування та виділення кисню компенсують один одного.
Оксиген сприяє кругообігу інших елементів, оскільки утворює з ними численні сполуки.

Схема 9. Застосування кисню
Кисень використовують у різних галузях, причому у великій кількості (схема 9). У металургії він прискорює процес виплавки сталі та покращує її якість. Цей газ необхідний у виробництві багатьох хімічних сполук, використовується у спеціальних пристроях для різання та зварювання металів (водневокисневого, ацетиленово-кисневого пальника).
Балони, наповнені киснем (рис. 66) або його сумішшю з інертним газомгелієм, використовують космонавти, військові льотчики, пожежники, водолази.

Мал. 66. Балон із киснем
Кисневі подушки застосовують при деяких захворюваннях для полегшення дихання. За допомогою зрідженого кисню створюють необхідні умови для згоряння пального у космічних ракетах.
Широко використовується і кисень, що входить до складу повітря. За його участю згоряє паливо на теплоелектростанціях, пальне у двигунах автомобілів, обпалюють металеві руди на заводах кольорової металургії.
Це цікаво
Отруєння чадним газом CO відбувається тому, що він реагує з гемоглобіном, і надходження кисню в організм припиняється.
Під час спалювання палива та пального утворюється та потрапляє у повітря значна кількість чадного (CO) та сірчистого (SO 2) газів. Ці речовини негативно впливають на рослини, викликають та загострюють хвороби у людей. Тому у кожній країні роботу промисловості, енергетики, транспорту організують так, щоб зменшити кількість шкідливих викидів у повітря. Охорона повітря від техногенних забруднень є важливою державною справою.
Біологічна роль кисню.
Кисень необхідний живим істотам для дихання. Потрапляючи через легені в організм, цей газ з'єднується з гемоглобіном (компонент крові) і надходить у всі органи та тканини. За участю кисню відбуваються різні реакції. Деякі їх супроводжуються виділенням теплоти; завдяки цьому підтримується постійна температуратіла.
Висновки
У природі атоми Оксигену внаслідок хімічних реакцій постійно переходять від одних речовин до інших; відбувається кругообіг цього елемента.
Кисень широко використовується у промисловості, техніці, медицині, а у складі повітря – у теплоенергетиці, автотранспорті, інших областях.
Кисень необхідний живим істотам. Потрапляючи в організм під час дихання, він бере участь у багатьох хімічних реакціях. Кисень є також продуктом фотосинтезу.
?
154. Як ви розумієте термін «кругообіг»?
155. Напишіть два-три рівняння реакцій, у яких відбувається зв'язування кисню.
156. Які заходи має вживати людство для збереження балансу кисню в атмосфері?
157. Відомо, що замість певного обсягу кисню, що споживається при диханні, у повітря надходить такий самий обсяг вуглекислого газу. Визначте об'ємну частку кисню в повітрі, що видихається, якщо об'ємна частка вуглекислого газу в ньому становить 5 %.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. – К.: ВЦ «Академія», 2008. – 136 с.: іл.
Зміст уроку конспект уроку та опорний каркас презентація уроку інтерактивні технології акселеративні методи навчання Практика тести, тестування онлайн завдання та вправи домашні завдання практикуми та тренінги питання для дискусій у класі Ілюстрації відео- та аудіоматеріали фотографії, картинки графіки, таблиці, схеми комікси, притчі, приказки, кросворди, анекдоти, приколи, цитати Додатки шпаргалки фішки для допитливих статті (МАН) література основна та додаткова словник термінів Вдосконалення підручників та уроків виправлення помилок у підручнику заміна застарілих знань новими Тільки для вчителів календарні плани навчальні програми методичні рекомендації